
Intercambialidade entre medicamento de referência, genérico e similar
Você conhece a diferença entre medicamentos de referência, genéricos e similares? Sabia que a troca entre eles deve atender às normas sanitárias, que define as regras de intercambialidade?
Vamos a algumas definições, de acordo com a Lei dos genéricos (Lei nº 9787, de 10 de fevereiro de 1999):
O medicamento de Referência, é o produto inovador registrado na Anvisa, cuja eficácia, segurança e qualidade foram comprovadas cientificamente na ocasião do registro.
O medicamento Similar é aquele que contém o mesmo princípio ativo, apresenta a mesma concentração, forma farmacêutica, via de administração, posologia e indicação terapêutica do medicamento de referência registrado na Anvisa, podendo diferir somente em características relativas ao tamanho e forma do produto, prazo de validade, embalagem, rotulagem, excipientes e veículos, devendo sempre ser identificado por nome comercial ou marca.
O medicamento Genérico é um medicamento similar a um produto de referência ou inovador, que se pretende ser com este intercambiável, geralmente produzido após a expiração ou renúncia da proteção patentária ou de outros direitos de exclusividade, comprovada a sua eficácia, segurança e qualidade, e designado pela DCB ou, na sua ausência, pela DCI.
Em outras palavras, para facilitar o entendimento, o medicamento de referência é basicamente o “original”. O medicamento similar e genérico são uma cópia do original. O genérico só pode ser comercializado com o nome do princípio ativo, enquanto o similar pode ter um nome comercial ou de marca. Além disso, eles não são exatamente iguais ao de referência, pois podem diferir em alguns aspectos, como tamanho ou forma do medicamento, embalagem e rotulagem, prazo de validade. Outro aspecto importante em que podem diferir são os excipientes e veículos, que são os componentes da formulação.
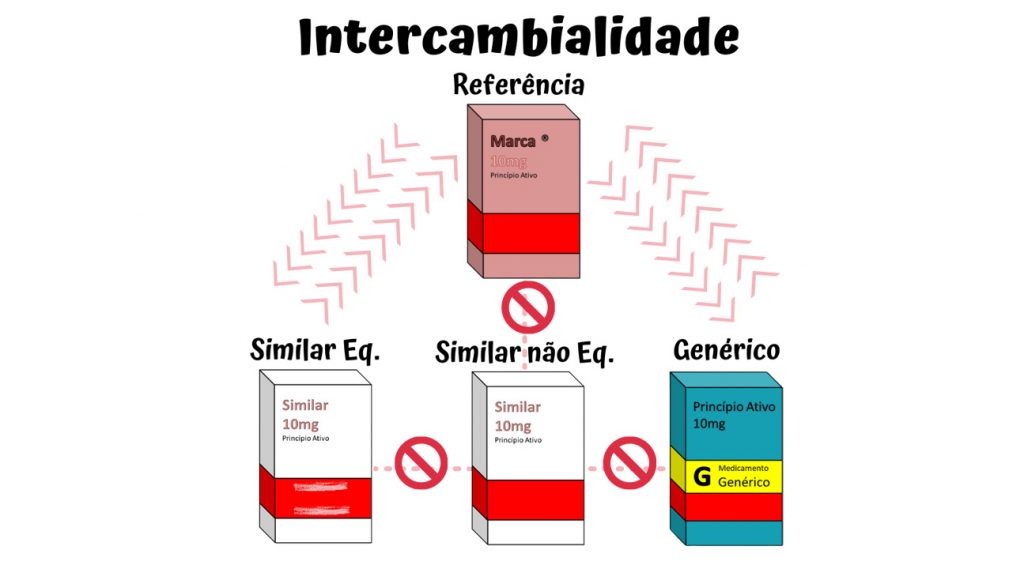
Justamente por não serem idênticos e por se tratar de medicamento, o procedimento de troca entre eles, conhecido como intercambialidade, deve obedecer às regras dispostas na legislação, e podem ser encontrados na Resolução RDC 16/07, RDC 58/2014 e NOTA TÉCNICA nº 23/2018. Para um medicamento similar ou genérico ser intercambiável com o medicamento de referência, ele deve passar por testes de biodisponibilidade relativa e equivalência farmacêutica que comprovem os mesmos efeitos de eficácia e segurança no organismo.
Obrigatoriamente, todos os medicamentos genéricos para obter seu registro devem passar por esses testes. Enquanto para os medicamentos similares, a obrigatoriedade foi a partir de 2003, com a Resolução RDC 134/2003 e Resolução RDC 133/2003. A informação a respeito da intercambialidade deve constar na bula do medicamento similar. A lista será atualizada à medida que novos similares forem registrados e renovados com a análise dos estudos comparativos citados. A ANVISA publica em seu site a relação dos medicamentos similares indicando os medicamentos de referência com os quais são intercambiáveis.
A dispensação de medicamentos em farmácia deve seguir algumas regras básicas:
• O similar que não passou por testes não pode ser trocado por nenhum outro, portanto só pode ser dispensado quando vier prescrito seu nome comercial.
• Prescrição com o nome do medicamento referência, pode ser substituído por qualquer um dos seus equivalentes farmacêuticos, isto é, pelo similar bioequivalente ou pelo seu respectivo genérico.
• Prescrição com o nome do similar bioequivalente, poderá ser feita a substituição somente pelo seu respectivo medicamento de referência
• Prescrição pela DCB (Denominação Comum Brasileira) ou DCI (Denominação Comum Internacional), ou seja, pelo nome do princípio ativo, podem ser dispensados somente o genérico ou referência, nesse caso específico não pode ser liberado o medicamento similar.
A troca de medicamentos só é proibida quando o médico expressa na própria receita que não autoriza a substituição do medicamento que ele prescreveu.
Retomando, a legislação vigente prevê apenas a (i) intercambialidade entre medicamento genérico e seu respectivo medicamento de referência, bem como a (ii) intercambialidade entre medicamento similar e o seu respectivo medicamento de referência, descrito na lista disponível no Portal da Anvisa.
A substituição de um medicamento de referência pelo genérico ou similar, é privativa do farmacêutico. Sempre que for realizada qualquer substituição da prescrição, o farmacêutico deve apor seu carimbo onde conste seu nome e número de inscrição do Conselho Regional de Farmácia, datar e assinar.
Se você ficou com alguma dúvida ou quiser saber mais sobre esse e outros temas, inscreva-se e acompanhe o canal Vida de Farmácia no Youtube.
 Por Thalita Lima | CRF-SP 85219
Por Thalita Lima | CRF-SP 85219
O Vida de Farmácia é um canal do Youtube, criado pela farmacêutica Thalita Lima, dedicado a farmacêuticos, balconistas e atendentes de farmácia. Seu objetivo é oferecer explicações de maneira clara e ilustrada sobre os diversos assuntos relacionados com o cotidiano da farmácia.

 Mudar país
Mudar país